奇妙无穷的全能干细胞

徐仁和 (Graduate Class-84)
Farmington, CT
美国康涅替克大学遗传与发育生物学系副教授,康大干细胞中心实验室主任。1983年获衡阳医学院(现南华大学)学士学位; 1987年获湖南医科大学(现中南大学)硕士学位; 1999年获日本东京大学博士学位。徐教授多年从事发育生物学及人胚胎干(ES)细胞和诱导性全能干(iPS)细胞研究, 主持多项研究课题。他在人全能干细胞自我更新和分化领域做出了一些重要贡献。例如最先发现BMP4可诱导人ES细胞分化为胎盘滋养细胞(Nature Biotechnology 2002); bFGF和BMP抑制剂能协同维持人ES细胞自我更新, 从而使人ES细胞培养不再需要动物滋养细胞 (Nature Methods 2005); TGF-beta信号介导因子SMAD2/3能结合并调控关键的全能基因NANOG (Cell Stem Cell 2008); 人iPS细胞的基因组稳定性及基因拷贝数变化(Nature Biotechnology 2011)。共发表科研论文近50篇。他领导的干细胞中心实验室成功建立了四株人ES细胞系和多株正常或与疾病相关的iPS细胞系,为康涅替克大学,Wesleyan大学,耶鲁大学, NIH 等机构的40多个实验室提供了干细胞来源。由于徐教授的突出成绩,他在1997年荣获美国NIH杰出科学进步奖,2007年康涅替克科研协会(CURE)干细胞研究特殊贡献奖,和2007年度康涅替克州蓝皮书荣誉证书。他是Cell Stem Cell,PNAS, Nature Biotechnology 等杂志的审稿专家,是美国马里兰和纽约州干细胞基金,英国医学研究会基金,荷兰科研组织(NWO),中国国家自然科学基金重点项目,及中国长江学者和千人计划的评审专家。
前言
上世纪末有人曾预言,二十一世纪将是生物学的世纪。毋庸置疑,干细胞已成为生物医学发展的一只领头羊。干细胞是一种处于未分化状态的细胞,可以无限增殖,还可以分化成特定的细胞类型。人体绝大多数器官都有干细胞存在,它们不仅可以维持自我更新,还为组织再生提供了基础。干细胞可以分化为新的健康细胞来替换衰老、损伤和功能异常的细胞从而达到维持体内自然平衡的目的。
干细胞分类
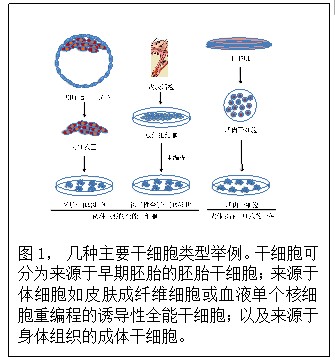 干细胞根据其来源可分为不同的种类 (图1)。胚胎干(ES)细胞来源于早期胚胎,而成体干细胞具有组织特异性,可以从体内绝大多数组织和器官中分离。例如,神经干细胞一般从中枢神经系统分离,可以分化为许多种类的神经细胞,包括神经元,神经胶质细胞和星形胶质细胞。 造血干细胞一般从骨髓分离,可以分化为所有种类的血细胞。干细胞还可以根据其分化能力被归类为完全全能性、全能性和多能性干细胞。
干细胞根据其来源可分为不同的种类 (图1)。胚胎干(ES)细胞来源于早期胚胎,而成体干细胞具有组织特异性,可以从体内绝大多数组织和器官中分离。例如,神经干细胞一般从中枢神经系统分离,可以分化为许多种类的神经细胞,包括神经元,神经胶质细胞和星形胶质细胞。 造血干细胞一般从骨髓分离,可以分化为所有种类的血细胞。干细胞还可以根据其分化能力被归类为完全全能性、全能性和多能性干细胞。
干细胞研究起源及发展
一九八一年,世界上首株ES细胞由小鼠囊胚分离建系成功。英国科学家Martin Evans(图2)因此于二零零七年获得诺贝尔生理医学奖[1]。十七年后,科学家才找到人ES细胞的建系方法。美国科学家James Thomson(图2)小组于一九九八年成功建立世界上最早的五株人ES细胞系[2],被《时代》周刊评为二零零零年度十大科技突破之首。在康涅替克大学,我们建立了四株人ES细胞系,分别命名为CT1、CT2、CT3和CT4(图3)。这四株干细胞系最近被美国国立卫生研究院(NIH)登记,成为现有的75株可供任何美国联邦资助研究的人ES细胞株的一部分
(http://grants.nih.gov/stem_cells/registry/current.htm)。

ES细胞之所以能引起全球科技和大众媒体的广泛关注主要是由于这种干细胞不同于以往发现的成体干细胞。ES细胞可以在体外无限扩增,还可以分化为身体二百二十多种组织的任何一种。迄今为止,ES细胞已被分化为神经、皮肤、视网膜、心脏、血液、骨, 软骨、肺、肝、肾、胰岛、肠道等多种重要组织器官的细胞。动物实验证明这些分化的细胞可治疗多种相关组织器官的疾病[3]。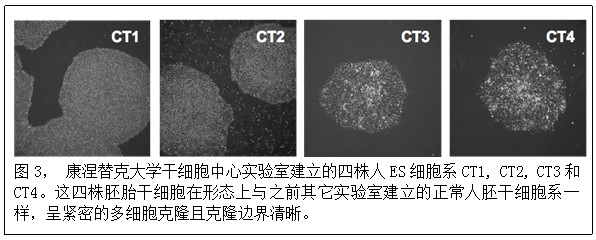
美国食品药物管理局(FDA)已批准加州Geron公司开展使用由人ES细胞分化的神经胶质细胞治疗急性脊髓损伤的人体试验(http://www.geron.com/products/productinformation/spinalcordinjury.aspx)。
诱导性全能干细胞系的建立
二零零六年日本科学家山中伸弥(Shinya Yamanaka)(图2)小组再创奇迹。他们通过重编程因子Oct4, Sox2, c-Myc, and Klf4使小鼠成体细胞(无需胚胎细胞)转变为具有ES细胞特性的细胞,即诱导性全能干(iPS)细胞[4]。在2007年,山中[5]和Thomson[6]实验室均报道了利用不同的重编程因子组合诱导人体细胞成为iPS细胞。山中实验室使用了与小鼠iPS相同的因子[5],而Thomson实验室则选择了OCT4, SOX2, NANOG和LIN28[6]。很快,许多实验室又先后建立了多株来源于具有遗传或非遗传疾病病人细胞的iPS细胞系[7]。这些iPS细胞系成为研究人类疾病的有利工具。
全能干细胞的应用
iPS细胞可由病人的体细胞转变而来,因此由其分化的组织细胞可被同一病人所接受。故此,iPS细胞既没有使用人胚的伦理问题,又可避免病人的免疫排斥。这些史无前例的优势将干细胞研究推向新高。iPS细胞和ES细胞一样,也可无限扩增并具有全能性,即可分化为身体任何组织细胞。故此,这两类干细胞同属全能干细胞, 目前都被广泛应用于再生医学的研究,期望治疗多种退行和损伤性疾病。迄今为止,已经有越来越多种类的全能干细胞被发现和确认[8]。已有报道, 一个建有180多株人ES细胞的细胞库可覆盖某个地区人群所有人白细胞抗原(HLA)的种类, 从而避免在移植这些干细胞所分化的体细胞时可能出现的免疫排斥[9]。与此同时,科学家发现人ES细胞可释放重要因子例如LEFTY[10]和其它小分子蛋白质[11]抑制癌细胞生长。我们还发现人ES细胞可能通过携带与癌抗原接近或相同的胚胎抗原诱导身体产生抗癌免疫[12]。这些研究表明人ES细胞不但可分化为具有重要功能的细胞来替代病变细胞,它们携带或释放的因子还可用来保护身体免受疾病侵害。
全能干细胞应用存在的问题及发展趋势
虽然上述进展振奋人心,在全能干细胞应用于病人之前仍有下列许多障碍需要排除。
- 培养条件依赖于动物产品。传统上,人ES和iPS细胞系建系于需要血清和饲养层细胞等动物来源产品的培养条件。 所以,异种病原体和免疫原可通过干细胞最终转移到病人体内。为了解决这一问题,我们[13]和其他科学家阐述了调节人ES细胞自我更新的重要的信号通路, 基于这些已开发的成分明确的无动物来源培养基。然而,除了少数包括神经细胞在内的细胞系的分化方法,很多用于分化干细胞的实验方法仍使用动物产品。 如何开发无动物来源的培养条件来分化干细胞仍然是个氶需解决的问题。
- 致肿瘤性。ES细胞和iPS细胞的全能性是把双刃剑: 它既可以使干细胞分化为任何具有治疗价值的细胞;又可使混入移植细胞的未分化干细胞在宿主体内产生畸胎瘤。因此,在移植前去除所有全能干细胞是十分重要的。
- 基因组完整性的缺失。如其它培养细胞一样,全能干细胞在长期培养过程中会出现细胞遗传的不稳定性。以前曾发现人ES细胞经常发生12,17及X染色体三倍性,及其它许多染色质和遗传物质的突变。这些遗传异常可能会造成干细胞全能性的损失(譬如,不能分化为某些体细胞)。最令人担忧的是由于抑制肿瘤抑制基因或活化癌基因而导致肿瘤。因此,避免培养过程中的细胞选择压力并追踪检测全能干细胞的遗传完整性,对于确保具有治疗价值的干细胞应用于再生医学的安全性十分重要。
另一种可能影响基因组完整性的原因是对干细胞及其母源细胞进行的基因操作。 例如,为了表达或抑制某个基因,需将编码mRNA或shRNA的DNA通过转染整合到干细胞基因组。在诱导iPS的过程中,编码重编程因子的DNA也需整合到体细胞基因组中。 这些随机插入干细胞的外源基因可以影响其基因组的完整性和临床治疗效果。尽管有通过蛋白质转染重编程因子的报道(蛋白质不会干扰基因组的完整性)[14],但其诱导效率极低, 还不能广泛应用。
除此之外,还有一些其它问题尚未引起广泛关注,例如,如何决定并获得针对某种疾病的理想细胞类型,以及如何实现和改善移植细胞在体内生存,整合, 和长期行使功能。可以预见,在对人全能干细胞进行的长期研究过程中,还会发现很多新的问题。但毫无疑问,科学家将会继续努力,一个又一个地扫除所有障碍, 从而开发全能干细胞对增进人类健康的巨大潜力。
参考文献
- Evans MJ, Kaufman MH (1981) Establishment in culture of pluripotential cells from mouse embryos. Nature 292: 154-156.
- Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, et al. (1998) Embryonic stem cell lines derived from human blastocysts. Science 282: 1145-1147.
- Brignier AC, Gewirtz AM (2010) Embryonic and adult stem cell therapy. J Allergy Clin Immunol 125: S336-344.
- Takahashi K, Yamanaka S (2006) Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126: 663-676.
- Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, et al. (2007) Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 131: 861-872.
- Yu J, Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL, et al. (2007) Induced pluripotent stem cell lines derived from human somatic cells. Science 318: 1917-1920.
- Park IH, Arora N, Huo H, Maherali N, Ahfeldt T, et al. (2008) Disease-specific induced pluripotent stem cells. Cell 134: 877-886.
- Martins-Taylor K, Xu RH (2009) Determinants of pluripotency: From avian, rodents, to primates. J Cell Biochem 109: 16-25.
- Lin G, Xie Y, Ouyang Q, Qian X, Xie P, et al. (2009) HLA-matching potential of an established human embryonic stem cell bank in China. Cell Stem Cell 5: 461-465.
- Postovit LM, Margaryan NV, Seftor EA, Kirschmann DA, Lipavsky A, et al. (2008) Human embryonic stem cell microenvironment suppresses the tumorigenic phenotype of aggressive cancer cells. Proc Natl Acad Sci U S A 105: 4329-4334.
- Giuffrida D, Rogers IM, Nagy A, Calogero AE, Brown TJ, et al. (2009) Human embryonic stem cells secrete soluble factors that inhibit cancer cell growth. Cell Prolif 42: 788-798.
- Li Y, Zeng H, Xu RH, Liu B, Li Z (2009) Vaccination with Human Pluripotent Stem Cells Generates a Broad Spectrum of Immunological and Clinical Response against Colon Cancer. Stem Cells.
- Xu RH, Chen X, Li DS, Li R, Addicks GC, et al. (2002) BMP4 initiates human embryonic stem cell differentiation to trophoblast. Nat Biotechnol 20: 1261-1264.
- Kim D, Kim CH, Moon JI, Chung YG, Chang MY, et al. (2009) Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell 4: 472-476.
王瑊玏:徐仁和研究室博士后。






